Cristallizzazione del sale: esperimento di chimica
Cristallizzazione del sale: esperimento di chimica. Relazione sulla cristallizzazione del sale da cucina e analisi della reazione e del processo di saturazione

CRISTALLIZZAZIONE DEL SALE

Cristallizzazione di sale: esperimento di chimica
Obiettivo: Partendo da una soluzione salina, verificare sperimentalmente la formazione di cristalli mediante evaporazione.
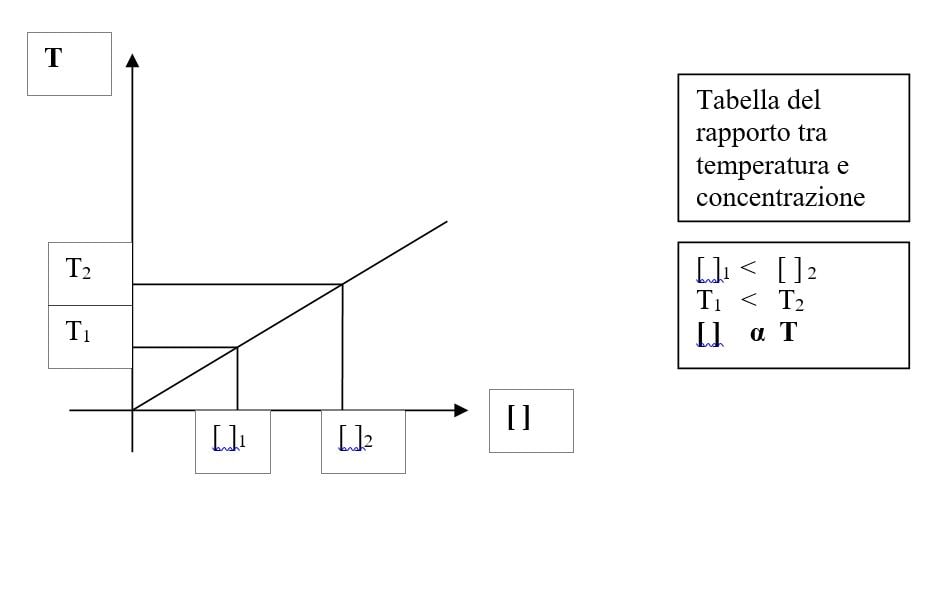
Premessa teorica: Aumentando la concentrazione di una soluzione salina si arriva a uno stato di saturazione che è direttamente proporzionale con la temperatura della soluzione, infatti con l’aumento della temperatura si alza il livello di saturazione.
Materiale chimico:
- NaCl = cloruro di sodio
- CuSO4 = solfato di rame
- H2O = acqua
Materiale di laboratorio:
- Spatola;
- Vetrino da orologio;
- Occhiali;
- Cristallizzatore;
- Becker;
- Beuta;
- Bacchetta di vetro;
- Imbuto;
- Carta da filtro;
- Termometro;
- Treppiede con retina;
- Sostegno con anello.
CRISTALLIZZAZIONE DEL SALE: PROCEDIMENTO
Mettiamo circa 100 ml di acqua distillata nella beuta e, dopo aver acceso il becco bunsen e posto sopra il treppiede, posizioniamo la beuta sul treppiede. Aggiungiamo gradualmente il sale da noi scelto e, mediante la bacchetta di vetro, mescoliamo la soluzione. Continuando ad aggiungere il sale controlliamo la temperatura della soluzione facendo bene attenzione a non toccare con il termometro il fondo della beuta che, essendo a contatto con la fiamma, aumenterebbe erroneamente la nostra misura (+5°,+10°C). Dobbiamo continuare ad aggiungere sale fino alla saturazione della soluzione, prestando attenzione a tenere la stessa al di sotto dei 70°, 80°C.
Contemporaneamente, su un secondo becco bunsen o alternando alla beuta, scaldiamo un becker contenente acqua, bastano 50 ml e lo portiamo ad una temperatura di circa 80°C. Inseriamo la carta da filtro all’interno dell’imbuto, che è sorretto dall’anello del sostegno, e poniamo il cristallizzatore sotto l’imbuto.
La nostra soluzione ha ormai raggiunto la saturazione e oscilla tra i 70°, 80°C. Facciamo scorrere l’acqua calda del becker nell’imbuto di modo tale che questo e l carta da filtro siano riscaldati prima della vera e propria filtrazione della soluzione che potrebbe, per lo sbalzo termico, cominciare a cristallizzare all’interno dell’imbuto. Con molta cautela procediamo ora alla filtrazione della soluzione che finisce nel cristallizzatore.
Curioso di riprovare a casa i tuoi esperimenti? Dai un'occhiata qui:
OSSERVAZIONI
Un’osservazione molto importante da fare è che abbiamo notato, avendo fatto l’esperimento con entrambi i sali, è che il cloruro si sodio ha una saturazione decisamente più elevata del solfato di rame. Infatti per il primo sono occorsi circa cinque vetrini da orologio mentre per il secondo ne abbiamo usati neanche due.
Subito dopo la filtrazione abbiamo osservato al microscopio presente in laboratorio qualche goccia della soluzione e abbiamo notato la formazione di piccoli cristalli. Successivamente abbiamo osservato lo stesso fenomeno a occhio nudo dopo aver lascito la soluzione a raffreddare per circa venti minuti.
Siamo tornati in laboratorio la settimana successiva e abbiamo osservato la formazione dei cristalli (per evaporazione) solo nella soluzione con il cloruro di sodio; evidentemente quella con il solfato di rame non aveva raggiunto lo stato di saturazione nemmeno tramite evaporazione, abbiamo posto il cristallizzatore nel frigorifero del laboratorio ma non abbiamo osservato la formazione di cristalli nemmeno in questo caso, dunque il livello di saturazione era molto basso.
Si è potuto osservare che i cristalli del cloruro di sodio sono trasparenti e di forma cubica.
Altri esperimenti da provare:
- Cristallizzazione del solfato di rame
Cristallizzazione del solfato di rame, esperimento: materiale occorrente, procedimento e conclusione dell'esperimento di laboratorio - Osmosi nella patata
Osmosi nella patata: osservazioni e guida dell'esperimento di chimica condotto in laboratorio


